L’immunothérapie (suite et fin) : l’envol d’un nouveau traitement
Figure 0 – Lymphocyte attaquant une cellule tumorale
« Une réaction inflammatoire au sein de la tumeur »
Nous avons vu que le mécanisme d’action de l’immunothérapie n’est pas une destruction par action directe sur les cellules tumorales mais une activation du système de défense immunitaire. Cette activation permet aux cellules lymphocytaires T de l’individu de jouer leur rôle tumoricide contre les cellules cancéreuses. Ce mécanisme est très différent de celui de la chimiothérapie classique qui consiste le plus souvent à provoquer la mort de la cellule en la bloquant en phase de division. Les cellules tumorales se divisant plus vite que les cellules saines, elles sont beaucoup plus sensibles à ce traitement : c’est l’effet différentiel. On comprend donc que les cellules saines des tissus à renouvellement rapide, comme les cellules des lignées sanguines, seront également victimes de l’action de la chimiothérapie, donnant cette toxicité hématologique bien connue pouvant conduire à l’aplasie.
Un des intérêts de l’immunothérapie est l’absence de cette toxicité limitante rencontrée en chimiothérapie. Finalement, en permettant l’activation des cellules lymphocytaires anti cellules cancéreuses l’immunothérapie provoque, en simplifiant, une réaction immune, ou une réaction inflammatoire au sein même de la tumeur. Ce mécanisme complexe met en jeu un grand nombre d’acteurs : la séquence – cellule dendritique reconnaissant l’antigène tumoral- cellule dendritique présentatrice de l’antigène- lymphocyte CD8 activé – couple lymphocyte CD8 et CD 4 helper tueurs de cellules tumorales est la voie principale sur laquelle agit la molécule d’immunothérapie. Bien d’autres éléments participent à cette réponse immunitaire comme les lymphocytes NK « Natural Killer », les cellules M1, les cellules myéloïdes suppressives, .. . (fig1)
Figure 1 les acteurs de la réponse immunitaire anti tumorale
De même les moyens employés pour tuer la cellule tumorale sont nombreux : médiateurs, cytokines, blocage par liaison antigénique, anticorps…
« une toxicité particulière »
Cet ensemble de cellules et de leur production est tumoricide. Il arrive que l’immunothérapie provoque son activation dans un tissu sain. La cible n’est plus alors la cellule cancéreuse mais la cellule saine de l’organe. Deux particularités de la toxicité de l’immunothérapie sont à retenir.
La première est qu’elle peut toucher n’importe quel organe.
La seconde est que son intensité est en règle beaucoup moins importante que celle de la toxicité liée à la chimiothérapie. Par exemple, dans les tumeurs pulmonaires pour des protocoles obtenant la même efficacité le pourcentage d’effets secondaires grade 3 et grade 4 (importants ou sévères) est de 50% pour la chimiothérapie comparé à 10% pour l’immunothérapie. (Borghaei et al. (2015). Nivolumab versus Docetaxel in advanced Nonsquamous NSCLC. N Engl J Med).
En revanche, les tentatives d’associer deux immunothérapies, notamment Nivolumab et Ipilimumab, fondées sur le fait que ces deux molécules agissent sur deux check point différents (voir l’article précèdent) font montés le taux de toxicité grade 3 et 4 à 53%. L’association de deux immunothérapies pourtant de faible toxicité doit donc être envisagée prudemment.
Revenons aux organes touchés par la toxicité de l’immunothérapie et au type de toxicité. La figure 2 montre la variété de ces atteintes toxiques. Tous les organes peuvent être touchés, sous forme d’inflammation ou, pour les organes glandulaires, de dysfonctionnement.
Figure 2. les toxicités de l’immunothérapie (Champiat et al. (2015). Management of Immune checkpoint blockade dysimmune toxicities: A collaborative position paper. Annals of oncology)
Beaucoup de ces toxicités ne surviennent qu’exceptionnellement mais elles sont tellement nombreuses que chaque médecin prescripteur en rencontre régulièrement. Elles sont si diverses que la prise en charge de la toxicité n’est plus du seul ressort du prescripteur mais fait appel à la pluridisciplinarité. En termes de symptôme rien n’est spécifique. Prenons par exemple une colite survenant sous immunothérapie. Le patient va présenter une banale diarrhée modérée sans autre symptôme. Lui-même bénéficiant de ce traitement depuis des mois sans gêne, menant une vie normale peut très bien omettre de signaler qu’il est sous immunothérapie. Sans ce renseignement, le diagnostic peut errer quelques temps. S’il s’agit d’une diarrhée liée à l’immunothérapie les différents traitements symptomatiques n’y feront rien et au fil des jours elle va s’aggraver. Une coloscopie peut faire le diagnostic si une biopsie est réalisée. En effet, l’examen anatomopathologique montrera … une infiltration lymphocytaire massive de la muqueuse bien sur ! Sinon quelques jours de corticothérapie font céder cette colite et la diarrhée, à condition qu’on y est pensé et également qu’il n y ai pas de point d’appel pour une autre étiologie. Car la contradiction qui tombe sous le sens, une corticothérapie en réduisant la réponse immunitaire traite efficacement la toxicité, mais … réduit l’efficacité sur la tumeur par le même mécanisme. Ceci souligne l’importance de la réflexion pluridisciplinaire dans la prise en charge des toxicités.
Ces nombreuses toxicités n’ont pas toute la même fréquence :
L’asthénie est notée chez 20% des patients, l’atteinte cutanée chez 15%, digestive 15%, pulmonaire 5% hépatique 5%…

Asthénie 20%
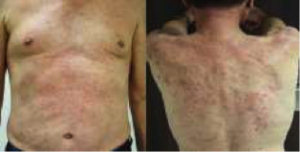
Cutané 15%

Poumon 5%

Digestif 15%
Dysthyroidie 5-10%
Les toxicités potentiellement les plus sévères sont heureusement beaucoup plus rares : inférieures à 1%

Myocardite
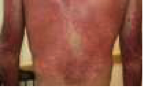
Steven Johnson
Guillain Barré Encéphalite
Cytopénies
Néphrite

Insuffisance surrénalienne
Acido cétose diabétique
Chaque molécule d’immunothérapie peut provoquer l’ensemble de ces toxicités. La fréquence de survenue varie cependant d’une molécule à l’autre. Par exemple la toxicité principale de l’Avelumab est l’asthénie chez 50 %des patients, alors que celle du Nivolumab est la toxicité cutanée à 52%.
Ces toxicités ne surviennent pas aux mêmes moments (fig 3). Les premières à apparaître sont les toxicités cutanées (rash, prurit..) après deux à trois semaines d’immunothérapie. Les toxicités gastro intestinales (diarrhées…) apparaissent entre 6 et 8 semaines, les endocrines (dysthyroïdies hypophysites…) en moyenne vers 9 semaines. Des effets secondaires peuvent apparaître 6 à 12 mois après l’arrêt de l’immunothérapie.
Anfig 3. Cinétique d’apparition des différentes toxicités. Antonia S et al, ESMO 2015, Abstr 346. Weber et al,. (2012). Management of immune related adverse events and kinetics of response with ipilimumab, JCO
Voici une liste non exhaustive du type d’effet secondaire les plus fréquents par organe :
- Cutanée : rash, prurit et vitiligo…
- Endocrine : hypothyroïdie, plus rares hyperthyroïdie, hypophysite, diabète..
- Hépatique : hépatite avec augmentation des ASAT, ALAT, bilirubine..
- Gastro intestinale : diarrhée, colite, rarement perforation colique, entérocolite survenant après l’arrêt du traitement…
- Poumon : pneumonite….
« Et dans la vraie vie … »
Il est important devant la variété des effets secondaires et le caractère aspécifique de certains symptômes d’être vigilant devant un patient en cours d’immunothérapie et même après l’arrêt du traitement. L’aspect de bon état général du patient peut être trompeur et faussement rassurant.
Ce traitement réputé bien toléré, compatible avec une vie quasi normale tant que le cancer est peu ou pas symptomatique en pratique l’est-il vraiment ? La réponse est oui. Il s’administre sous forme de perfusion en 30 à 60 minutes en ambulatoire. Il y a rarement des réactions toxiques aigues, qui sont alors des réactions allergiques ou cutanées. Le patient en règle ne ressent rien lors de la perfusion. La molécule d’immunothérapie est administrée seule. Il n’y a besoin d’aucune prémédication comme celle de la chimiothérapie (anti émétiques, anti histaminiques, corticoïdes.).
Une asthénie peut survenir dans les jours qui suivent la perfusion. Elle est souvent plus marquée après les premières perfusions puis elle s’estompe. Les perfusions sont réalisées toutes les deux ou trois semaines.
Nous l’avons vu dans l’article précédent, il existe des réponses spectaculaires mais elles sont rares. Les taux de réponses complètes ou partielles sont d’ailleurs peu élevés, meilleurs dans les tumeurs cutanées et pulmonaires que dans les autres organes. En revanche les patients qui sont bons répondeurs sont souvent longs répondeurs. La réponse tumorale est évaluée deux à trois mois après le début du traitement. Dans la majorité des cas, cette réponse, lorsqu’elle existe est lente à se dessiner. Il peut exister dans les premières semaines de traitement une pseudo progression, augmentation du volume tumoral lié à l’afflux de lymphocytes et à l’augmentation de l’inflammation tumorale. Il n’est donc pas toujours facile d’évaluer précocement l’effet de l’immunothérapie sur la tumeur. Le délai relatif entre le début de l’immunothérapie et la réponse tumorale rappelle que pour une tumeur agressive et à extension rapide la chimiothérapie classique reste plus efficiente. C’est le cas des tumeurs ORL pour lesquelles la comparaison entre la chimiothérapie de référence et l’immunothérapie montre que dans les premiers mois de traitement la courbe de survie est meilleure avec la chimiothérapie alors qu’à deux ans de suivi c’est l’immunothérapie qui garde le plus de patient en vie.
L’histoire de l’immunothérapie en oncologie ne fait donc que commencer. De nouvelles molécules agissant sur de nouveaux check point sont en cours de développement. Vraisemblablement les associations de différentes classes d’immunothérapie agissant sur différents check point sont une voie de progrès tout en majorant la toxicité. L’association avec la chimiothérapie classique est également une voie de recherche en cours. Mais déjà de nouvelles molécules agissant de façon différentes sur le système immunitaires comme les réactivateurs de l’apoptose (inhibée dans les cellules tumorales) apparaissent, de nouvelles méthodes comme les CAR-T cell, utilisation de lymphocytes T autologues, c’est-à-dire du patient lui-même, capables de reconnaitre spécifiquement les cellules cancéreuse sont en cours d’évaluation.
La saga de l’immunothérapie continue, que la force soit avec les patients.
 Dr Laurent Martin, oncologue radiothérapeute
Dr Laurent Martin, oncologue radiothérapeute